陈苏仁课题组在CMLS发表文章揭示微管腔内结合蛋白TEKTIP1调控精子鞭毛轴丝稳定性的作用
2024年3月7日,北京师范大学陈苏仁课题组在国际细胞分子生物学领域知名期刊Cellular and Molecular Life Sciences发表了题为Tektin bundle interacting protein, TEKTIP1, functions to stabilize the tektin bundle and axoneme in mouse sperm flagella的研究论文,通过基因敲除小鼠和分子生化手段揭示了TEKTIP1蛋白发挥着稳定精子鞭毛微管腔内tektin束和轴丝稳定性的关键作用,推动了人们对于精子运动结构与分子机制的科学认识。

精子鞭毛以“9+2”轴丝为核心,环绕着中央2个单体微管的是9个外周二联体微管(Doublet microtubule, DMT),其中A管为完全微管,B管为不完全微管。DMT中含有多种微管腔内结合蛋白(Microtubule inner protein, MIP),这些蛋白被推测对DMT的稳定性至关重要。哺乳动物精子DMT的特征是其复杂的筑丝蛋白(tektin)束几乎填满了整个A管。在哺乳动物中发现了5种不同的tektin(tektin1~5)组成,tektin1~5基因敲除不同程度地影响了小鼠精子运动能力,研究人员还在弱精子症患者中鉴定到了TEKT3基因突变。
2021年,Gui M等人在Cell杂志发表文章[1]首次利用冷冻电子显微镜(cryo-EM)解析了牛气管纤毛的DMT结构,发现一种功能未知的新蛋白,命名为TEKTIP1(Tektin bundle interacting protein 1),其位于tektins束的中心,因此推定TEKTIP1可能发挥着组装和/或稳定tektins束的关键功能。
陈苏仁课题组利用CRISPR/Cas9基因编辑技术构建了Tektip1基因敲除小鼠,敲除鼠生长发育正常但雄性生育力显著降低,主要表现为一定程度的精子轴丝结构破坏和精子运动轨迹改变(图1)。
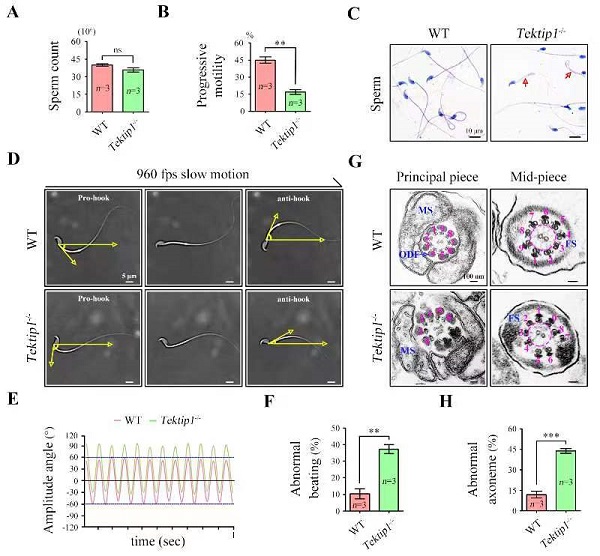
图1. Tektip1基因敲除小鼠精子运动轨迹和鞭毛轴丝结构
Tektip1基因敲除并不影响tektin 1~5蛋白的表达,但生化实验显示其干扰了tektin蛋白的互作和组装。Tektip1基因敲除小鼠睾丸中tektin 3的单体含量升高,而其聚体含量减低;另外,tektin 3与tektin 1、tektin 2和tektin 4间的相互作用显著减弱。
综上所述,本项研究对cryo-EM所解析的MIP结构进行了功能性验证,揭示了TEKTIP1蛋白的确发挥着稳定tektin束和轴丝结构的关键作用(图2)。TEKTIP1基因突变可能是弱精子症潜在的致病遗传因素,尚需与临床结合开展相关研究。
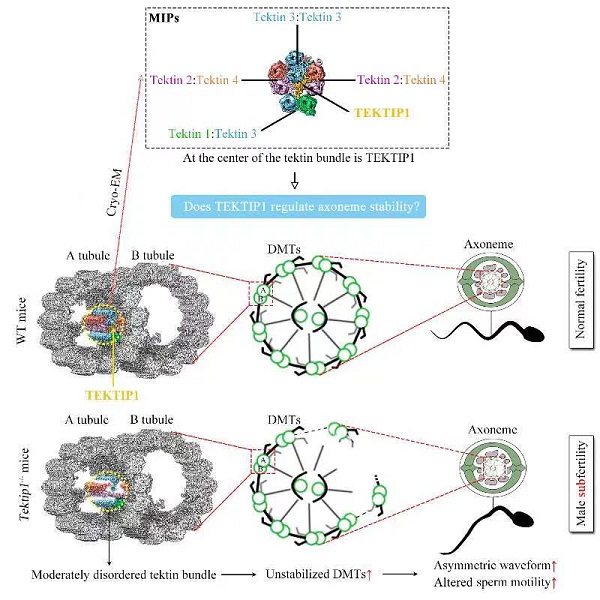
图2. 模式图
值得一体的是,2023年Chen Z等人在Cell杂志发表文章[2]利用cryo-EM解析了Tekt5基因敲除小鼠精子鞭毛的DMT结构,发现tektin 5蛋白的缺失扰动了微管内组分的分布,将cryp-EM与基因敲除小鼠第一次结合起来。未来,利用cryo-EM解析Tektip1基因敲除小鼠精子鞭毛的DMT的近原子分辨率结构,这将为理解Tektip1蛋白缺失如何影响tektin束组装提供直接证据。
北京师范大学为第一完成单位,陈苏仁副教授为最后通讯作者,在读硕士研究生耿新燕为第一作者,该项研究受到国家自然科学基金面上项目(32370905)等基金的资助。
原文链接:
https://link.springer.com/article/10.1007/s00018-023-05081-3
参考文献:
[1] Gui M, Farley H, Anujan P, Anderson JR, Maxwell DW, Whitchurch JB, Botsch JJ, Qiu T, Meleppattu S, Singh SK, Zhang Q, Thompson J, Lucas JS, Bingle CD, Norris DP, Roy S, Brown A. De novo identification of mammalian ciliary motility proteins using cryo-EM. Cell. 2021; 184(23):5791-5806.
[2] Chen Z, Shiozaki M, Haas KM, Skinner WM, Zhao S, Guo C, Polacco BJ, Yu Z, Krogan NJ, Lishko PV, Kaake RM, Vale RD, Agard DA. De novo protein identification in mammalian sperm using in situ cryoelectron tomography and AlphaFold2 docking. Cell. 2023; 186(23):5041-5053
