生命科学学院刘光伟课题组发现滤泡辅助性T细胞分化调控肿瘤免疫新机制
细胞免疫疗法已经显示出抗肿瘤免疫治疗的独特优势。在免疫细胞抗肿瘤治疗中,CD4+ T细胞可以通过发育分化为滤泡辅助T细胞(follicular T helper cells; TFH)并通过调节生发中心(germinal center; GC),可以直接影响B细胞分化和成熟,介导抗肿瘤体液适应性免疫调节。然而,TFH细胞分化和调节的机制目前尚不完全清楚。
2024年4月18日,生命科学学院刘光伟教授团队、军事医学研究院毕玉晶研究员团队合作在Cancer Immunology Research发表了题为“SIRT3 negatively regulates TFH cell differentiation in cancer”的研究论文。研究发现,定位于线粒体的NAD+依赖性去乙酰化酶Sirtun 3(SIRT3)可调控TFH分化和功能并在抗肿瘤免疫中发挥关键调控作用。这项研究为靶向T细胞亚群肿瘤免疫治疗策略研究提供了新的实验依据。

研究者首先采用生物信息学方法,分析了新冠肺炎感染者血液中CD4+ T细胞的数据和胸腺瘤癌症患者的数据等。数据显示,SIRT3表达可能与TFH细胞分化功能及抗病毒感染和抗肿瘤免疫调节有关。而在荷瘤小鼠中,研究者采用小鼠淋巴瘤(EL-4)和黑色素瘤(B16·F10)荷瘤小鼠,证实了SIRT3表达与肿瘤局部TFH细胞浸润百分率及肿瘤增殖明显相关联。进一步,为揭示SIRT3在抗肿瘤免疫中对TFH细胞分化和功能的调控作用。研究者采用SIRT3条件性T细胞缺失小鼠(Sirt3∆CD4),发现Sirt3∆CD4促进小鼠肿瘤生长。而且,肿瘤局部浸润T细胞中TFH细胞明显增多,GC B细胞、浆细胞及B细胞产生抗体IgG和IgM增多。进一步,采用细胞过继转移实验直接观察了SIRT3诱导TFH细胞分化在抗肿瘤中的作用。分选野生型对照小鼠和Sirt3∆CD4小鼠未分化T细胞(naïve T cells)进行过继免疫,观察对受者荷瘤小鼠肿瘤生长情况。结果发现,接受过继转移供者Sirt3∆CD4小鼠T细胞的受者小鼠肿瘤增长更大,肿瘤局部出现更多的供者来源TFH细胞分化浸润。这表明,SIRT3小鼠缺失促进TFH细胞分化具有抗肿瘤增殖效应。
同时,该研究还揭示了TFH细胞分化中NAD+-依赖性代谢调控子SIRT3新的代谢调控机制(图1)。研究发现,SIRT3缺失可以明显抑制线粒体功能包括氧化磷酸化活性。然而,受损的氧化磷酸化(OXPHOS)信号却补偿性地触发NAD+-糖酵解途径,可以有效提供细胞能量供应,这对SIRT3缺乏诱导的TFH细胞分化是非常重要的。阻断NAD+合成-糖酵解信号传导或恢复OXPHOS活性逆转了SIRT3缺乏诱导的TFH细胞分化。此外,mTOR和HIF1α信号在SIRT3缺陷诱导的TFH细胞分化中发挥关键调控作用。HIF-1α可以直接与转录因子Bcl-6相互作用并调节其活性。因此,这项研究揭示了一种新的细胞能量补偿机制,该机制由线粒体传感器SIRT3调节,在线粒体OXPHOS损伤,通过mTOR-HIF1α-Bcl-6信号途径触发NAD+依赖性糖酵解代谢活性,可以重新编程TFH细胞分化。以上研究结果将为癌症的免疫新疗法策略研究提供新的实验依据。
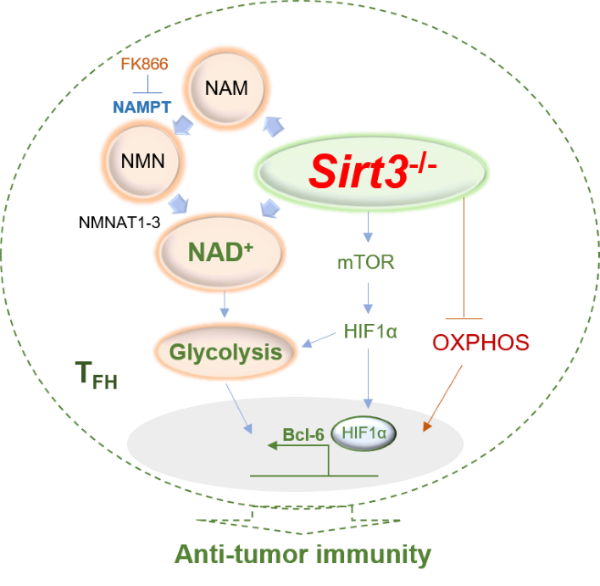
图1. SIRT3-NAD+代谢环路调节TFH细胞分化发挥抗肿瘤免疫效应
北京师范大学生命科学学院刘光伟教授和军事医学研究院毕玉晶研究员是本文的共同通讯作者。北京师范大学硕士毕业生侯月薷、博士研究生曹烨瑾、硕士毕业生何颖和出站博士后董琳等为本文的共同第一作者。研究生赵龙昊、董瑛洁及牛瑞颖参与了部分工作。该工作得到了国家自然科学基金重点项目(31730024)和面上项目(32170911和31970863)及北京市自然基金(5202013)等资助。
原文链接:https://doi.org/10.1158/2326-6066.CIR-23-0786
