刘光伟课题组在《American Journal of Transplantation》发表移植免疫排斥中髓系抑制细胞发育分化调控新机制
髓系抑制细胞(MDSCs)是来自骨髓祖细胞或未成熟髓细胞,在癌症、感染、自身免疫病和器官移植排斥中表现出负向调节免疫反应功能。在正常情况下,它是树突状细胞(DC)、巨噬细胞和粒细胞的前体,可以快速分化为成熟的粒细胞、DC和巨噬细胞,并进入器官和组织执行正常的免疫功能。在病理条件下,如器官移植物免疫排斥中,这些骨髓来源的祖细胞成熟可被细胞因子阻断,使其处于不同的分化阶段,而成为具有免疫抑制功能的MDSCs。尽管MDSC在肿瘤和器官移植排斥等免疫相关疾病中发挥着至关重要的作用,但其调控机制仍不清楚。
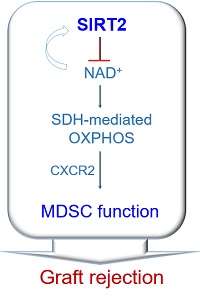
2023年8月24日,北京师范大学生命科学学院刘光伟教授团队在American Journal of Transplantation在线发表了题为“Deacetylase SIRT2 negatively regulates MDSC functions in allograft rejection”的研究论文(如下图)。研究发现了去乙酰化酶SIRT2通过调节NAD+-琥珀酸脱氢酶(SDHA)-氧化磷酸化(OXPHOS)代谢途径明显抑制MDSC功能,并在促进同种异体移植物免疫排斥中发挥关键调控作用。

研究采用同种异体皮肤移植小鼠观察了CD11b+Gr1+细胞在同种异体排斥反应中的功能变化,发现SIRT2在CD11b+Gr1+细胞中的表达可能与其功能变化有关。通过构建髓系细胞SIRT2基因条件缺失小鼠,发现SIRT2基因缺失明显延迟同种异体皮肤移植物存活。分析移植物局部浸润的免疫细胞种类,发现SIRT2基因缺失主要引起CD11b+Gr1+髓系抑制细胞(MDSC)浸润明显增多,而对其他免疫细胞无明显影响。
进一步,研究者采用基因缺失小鼠结合体内外实验较详尽解析了去乙酰酶SIRT2对MDSC功能分化的调控效应。在同种异体皮肤移植小鼠,SIRT2基因缺失明显促进MDSC的抗炎细胞因子IL-10分泌,抑制促炎细胞因子TNFα分泌并明显增强MDSC的免疫抑制活性和中性粒细胞胞外诱捕网(NET)产生。有趣的是,小鼠体内剔除CD11b+Gr1+MDSC,SIRT2基因缺失引起的皮肤移植物存活效应消失。而过继SIRT2基因缺失的CD11b+Gr1+MDSC入皮肤移植受者小鼠,可以明显延长受者小鼠皮肤移植物存活。这说明,靶向MDSC的SIRT2信号可以调控同种异体皮肤移植物存活。CXCR2有助于SIRT2基因诱导MDSC的细胞因子分泌和NET产生。
SIRT2是NAD+依赖的去乙酰化酶。SIRT2缺失明显上调NAD+信号分子表达和NAD+水平。在体外MDSC诱导体系,补充NAD+或者上调NAD+信号活性,可以明显促进MDSC的免疫抑制活性。重要的是,阻断NAD+信号活性,可以明显恢复SIRT2基因缺失引起的MDSC功能变化。说明,SIRT2通过NAD+依赖机制调控MDSC功能。进一步,研究发现NAD+信号可以明显改变MDSC氧化磷酸化(OXPHOS)水平,而不影响细胞糖酵解活性。发现琥珀酸脱羟酶A(SDHA)是调控OXPHOS的关键分子。靶向MDSC的SDHA-OXPHOS信号干预,可以明显恢复SIRT2基因缺失导致的MDSC功能活性变化(如下图)。
北京师范大学王宇飞博士生和曹烨瑾博士生为本文的共同第一作者。北京师范大学生命科学学院刘光伟教授是本文的通讯作者。该工作得到了国家自然科学基金重点项目、面上项目及北京市自然科学基金项目等资助。
原文链接: https://doi.org/10.1016/j.ajt.2023.08.017
