陈苏仁课题组在柳叶刀旗下eBioMedicine发文揭示了CFAP70基因为男性少弱畸形精子症的致病基因及其发病机理
2023年6月22日,北京师范大学陈苏仁课题组在《柳叶刀》子刊(The Lancet Discovery Science)eBioMedicine(医学1区Top,IF:11.205)发表了题为CFAP70 is a solid and valuable target for the genetic diagnosis of oligo-astheno-teratozoospermia in infertile men的研究论文,证明了CFAP70基因是男性少弱畸形精子症可信的致病靶标之一,为男性不育的基因诊断、辅助生殖治疗和遗传咨询提供了参考。

人口问题是“国之大者”,我国正面临人口负增长、不孕不育率持续升高和男性不育遗传诊断率极低等多重压力。在此社会背景下,生殖生物学与医学的科学研究将为逐步解决我国人口问题提供重要的理论支撑。在不孕不育中,男性因素约占40%-50%,患者常表现为少、弱、畸形精子症和不明原因的不育症。由遗传因素导致的男性不育,首先要寻找致病基因变异,既可避免不必要的药物治疗,也将为患者明确诊断并推荐合适的辅助生殖技术和遗传咨询提供依据。因此,基础联系临床,研究遗传学因素在精子发生过程中的作用与机制对于男性不育症患者具有现实价值。陈苏仁课题组深耕于男性不育遗传学领域,取得了一系列研究成果,发表于Human Reproduction Update[1]、Science Advances[2]、Cell Reports[3]和Development[4]等国际一流期刊。
2019年,法国Charles Coutton实验室在167例精子鞭毛多发形态异常(Multiple morphological abnormalities of the sperm flagella,MMAF)的男性不育患者中发现了2例患者携带CFAP70基因突变[5]。然而,CFAP70蛋白在哺乳动物精子鞭毛发育中的生理功能、鉴定到的点突变对CFAP70蛋白功能的影响以及致病机理尚不清楚,临床工作者对CFAP70基因是否应作为少弱畸形精子症的致病遗传靶标尚存疑虑。
本篇eBioMedicine论文中,研究团队首先构建了Cfap70基因敲除小鼠,并发现敲除鼠主要表现出脑积水和少弱畸形精子症,透射电子显微镜揭示了敲除鼠精子鞭毛的组装出现缺陷。CFAP70蛋白通过稳定精子鞭毛发育相关蛋白(如QRICH2和TTLL5等)、促进钙调蛋白—放射轴相关蛋白复合体(Calmodulin- and radial spoke-associated complex)在胞质中的预组装、影响微管运输蛋白IFT88和轴丝结构蛋白在精子微管系统上的准确定位等方式调控精子鞭毛的组装。研究团队针对一个少弱畸形精子症的男性不育家系,开展了全外显子测序(Whole-exome sequencing,WES)及筛选分析,鉴定到了CFAP70基因纯合无义突变(c.2962C>T/p.R988X)。野生型CFAP70蛋白大小为128千道尔顿,该无义突变产生了截短型的CFAP70蛋白(大小约为110千道尔顿),其缺失了第5-8个三十四肽重复序列(Tetratricopeptide repeats,TPR)结构域。研究团队继而构建了疾病相关动物模型并发现Cfap70基因点突变小鼠(携带与患者同源位置的突变)很好地模拟了患者的少弱畸形精子症表型,该体内证据还证明了5~8 TPR结构域对CFAP70蛋白的功能至关重要。
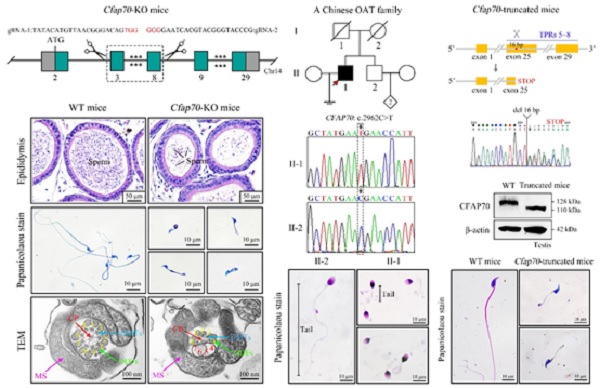
图1. Cfap70基因敲除小鼠、CFAP70基因突变家系和Cfap70基因点突变小鼠
综上所述,该篇研究论文利用基因敲除小鼠模型揭示了CFAP70蛋白调控哺乳动物精子鞭毛发育的生理功能及其分子机制,在男性少弱畸精子症患者中发现了CFAP70基因的全新突变,并利用疾病相关动物模型揭示了突变的致病性以及CFAP70蛋白5-8 TPR结构域的重要性。该研究基础密切联系临床,证明了CFAP70基因突变是男性少弱畸形精子症可信的致病遗传因素,其有望发展成为男性少弱畸精子症患者临床遗传筛查的靶标之一。
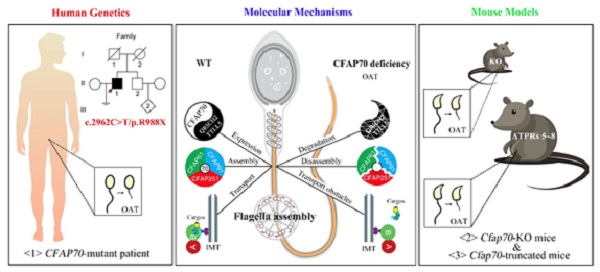
图2. 图文摘要
北京师范大学生命科学学院陈苏仁副教授和国家卫健委科学技术研究所王彬彬研究员为该论文的共同通讯作者,北京师范大学生命科学学院金慧娟博士研究生和右江民族医学院王俊利教授为共同第一作者。北京师范大学为第一完成单位。
原文链接:
https://www.sciencedirect.com/science/article/pii/S2352396423002402
参考文献:
[1] Jiao SY, Yang YY, Chen SR. (2021) Molecular genetics of infertility: loss-of-function mutations in humans and corresponding knockout/mutated mice. Human Reproduction Update. 27(1):154-189.
[2] Zhang XG, Zheng R, Liang C et al. (2022) Loss-of-function mutations in CEP78 cause male infertility in humans and mice. Science Advances. 8, eabn0968.
[3] Zhang XZ, Wei LL, Jin HJ et al.(2022)The perinuclear theca protein Calicin helps shape the sperm head and maintain the nuclear structure in mice. Cell Reports. 40(1):111049.
[4] Zhang XZ, Wei LL, Zhang XH et al.(2022)Loss of perinuclear theca ACTRT1 causes acrosome detachment and severe male subfertility in mice. Development. 149(12):dev200489.
[5] Beurois J, Martinez G, Cazin C et al. (2019) CFAP70 mutations lead to male infertility due to severe astheno-teratozoospermia. A case report. Human Reproduction. 34(10):2071-2079.
